9月19日,罗氏(Roche)宣布欧盟委员会(EC)已批准其双特异性抗体疗法Vabysmo(faricimab)上市,用于治疗新生血管性或湿性年龄相关性黄斑变性(nAMD)以及由糖尿病性黄斑水肿(DME)导致的视力障碍,这些视网膜疾病是全球视力丧失的两个主要原因。根据罗氏的新闻稿,“对于欧洲患有这些疾病的人来说,今天的批准提供了十多年来一个具有新型作用机制的治疗选择”。
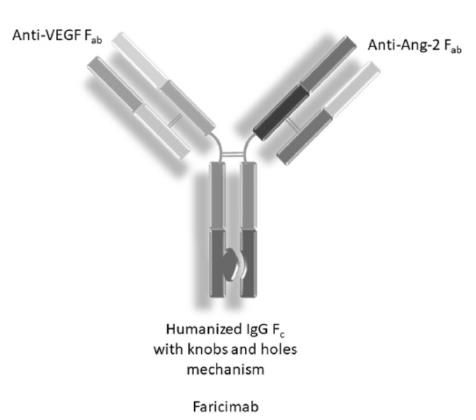
Vabysmo是一种双特异性抗体,它可以同时靶向阻断两条关键致病通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A)。这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。同时靶向这两条通路可以起到一定的互补作用,因此Vabysmo有望稳定血管,改善患者的视力。
目前,Vabysmo已在欧盟和世界上其它9个国家获得批准上市,用于治疗nAMD和DME患者。在美国,该药于2022年1月获得FDA批准治疗AMD和DME,成为了一款获FDA批准治疗这两种眼科疾病的双特异性抗体。在中国,该产品的上市申请已于今年8月获得中国国家药监局药品审评中心(CDE)受理。
▲Vabysmo(faricimab)结构示意图(图片来源:参考资料[3])
本次在欧洲的获批是基于四项3期临床试验的积极结果,其中两项针对的是湿性AMD患者,另两项针对的是DME患者,共涉及3220名患者。试验结果表明,与每两个月给予aflibercept相比,每隔四个月给予Vabysmo的患者获得了相似的视力改善和解剖改善。
这四项研究为期两年的总体数据显示:在接受Vabysmo治疗的患者中,超过60%的患者能够将治疗延长到每四个月一次,同时改善和维持视力;此外,与aflibercept相比,接受Vabysmo治疗的nAMD患者的中位数注射次数减少了33%(10次 vs 15次),接受Vabysmo治疗的DME患者的中位数注射次数减少了21%(11次 vs 14次)。
根据罗氏的新闻稿,Vabysmo是目前欧洲批准的少有一种可注射的眼科药物,其3期临床研究支持对nAMD和DME患者进行长4个月的间隔治疗。随着时间的推移,Vabysmo可能需要更少的眼部注射,同时还可以改善和维持视力和解剖结构,可以为患者和他们的护理人员提供一种更好的治疗方案。
“许多患有nAMD和DME的人很难坚持每月的眼部注射和就医,这通常与当前的护理标准有关,不幸的是,他们的视力可能会因为治疗不足而受损。” 眼科专家Ramin Tadayoni教授表示,“对于欧洲患有这些疾病的人来说,今天的批准提供了十多年来一个具有新型作用机制的治疗选择。随着时间的推移,这种疗法可以通过较少的注射来改善和保护他们的视力。”
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com