哈佛联合杜克大学创造出全人源卵巢类器官,有望开创癌症等治疗新方法
人类的生命起初从母体卵巢内的卵细胞开始孕育;然而,令人惊讶的是,作为人类重要生殖器官的卵巢却未被很好地研究。科学剑门一直致力于创建人类卵巢的体外模型,以便更深入地了解卵巢疾病并探索相关治疗方法。但现有模型大多为人类细胞和小鼠细胞的组合体,因而并不能够忠实地复制人类卵巢功能;此外,它们也需要花费许多时间在实验室中发育成熟。
近日,来自哈佛大学Wyss生物启发工程研究所、哈佛医学院和杜克大学研究人员与Gameto(一家致力于改善女性生殖疾病疗法的生物技术公司)公司合作,创建了一种全人源卵巢类器官,该类器官能够支持卵细胞成熟、实现卵泡发育和分泌性激素。无需从患者身上获取组织,这种被称为“ovaroid”的模型即可支持人类卵巢生物学相关的研究,并且可以开发针对不孕症、卵巢癌等疾病的新疗法。
该技术目前已授权给Gameto公司;“ovaroid”模型在研究团队近日发表于eLife杂志的论文中被详细描述。
全人源性卵巢类器官
发育中的卵巢包含生殖细胞(后续生长成卵细胞)以及体细胞(支持生殖细胞生长)。当前的卵巢实验室模型使用了人类的生殖细胞和小鼠的体细胞;因此,Smela博士以及团队成员想看看是否可以诱导人类干细胞生长成为一种功能性全人源性卵巢(意味着该全人源卵巢类器官将有着人源性生殖细胞和体细胞)。
研究团队决定以颗粒细胞为目标——颗粒细胞是一种卵巢体细胞,能够支持卵泡内未受精卵细胞的发育,并分泌性激素雌二醇和孕酮。尚未有方法可以从人类诱导性多能干细胞(iPSCs)中有效地产生颗粒细胞,因此,研究团队决定创建自己的方法。
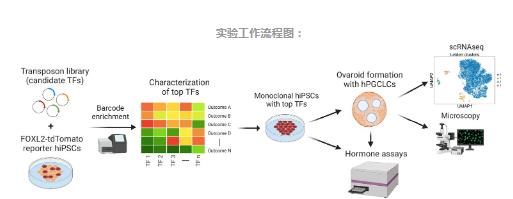
实验工作流程图:
iPSC技术的新兴领域是基于这样的发现:将称为转录因子(TFs)的蛋白质(它们直接与DNA结合,并控制某些基因的“开”或“关”)引入人类诱导性多能干细胞(iPSCs),这些转录因子将引导人类iPSCs分化成神经元、成纤维细胞等不同类型的细胞。研究团队选择采用该策略来产生人类颗粒细胞。通过““piggyBac转位”技术,研究者将35个候选TFs插入到iPSCs基因组中。
当这些TFs在iPSCs中表达后,研究者筛选了细胞,已查看哪些细胞产生了一种叫做FOXL2的蛋白质——颗粒细胞的一种已知标志物。确定了六个与FOXL2表达相关的TF:NR5A1,RUNX1 / RUNX2,TCF21,GATA4,KLF2和NR2F2。接下来,研究者测试了这些候选TF的不同组合,发现NR5A1和RUNX1或NR5A1和RUNX2这两种组合始终上调FOXL2。这两种组合还驱动了AMHR2和CD82两种蛋白质的表达——它们是在颗粒细胞上发现的表面标志物(surface markers)。
然后,研究人员观察了这些新细胞的完整转录组,发现它们表达了许多其他已知在颗粒细胞中活跃的基因。当研究者将这些新细胞的数据与其他人类胎儿卵巢细胞研究数据进行比较时,发现新细胞在基因表达上与妊娠12周时人类卵巢中的颗粒细胞相似。值得注意的是,该新方法仅仅花了五天时间。
为了确保这些新的颗粒样细胞也能复制正常的颗粒细胞功能,研究人员用雄烯二酮处理这些颗粒样细胞,然后添加卵泡刺激素(FSH)。这些细胞在不添加FSH的情况下成功地从雄烯二酮中产生雌二醇;添加FSH时,其产量增加。这些颗粒样细胞还产生了黄体酮——正常人类颗粒细胞在排卵后会分泌黄体酮。
用16%的时间实现了100%人源性
新颗粒样细胞的功能与真实细胞非常相似,研究人员将它们与人类原始生殖细胞样细胞(hPGCLCs)共同培养,以形成包括生殖细胞和体细胞在内的卵巢类器官或“ovaroids”。
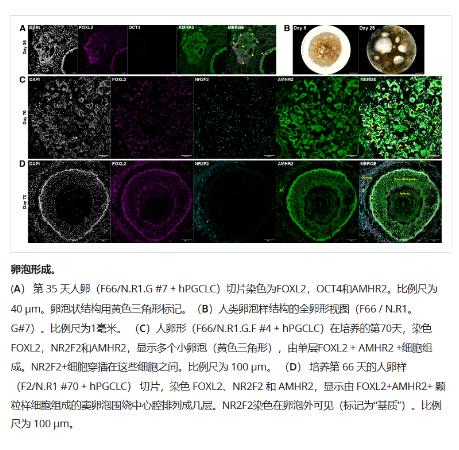
在用hPGCLCs共培养颗粒样细胞四天后,开始产生一种叫做DAZL的蛋白质(一种预示着生殖细胞开始成熟之旅的标志物)。相比之下,用小鼠体细胞制成的类卵巢直到第32天才表达DAZL。人类生殖细胞的寿命不足以进一步发育成卵细胞,但类卵巢细胞在大约 16 天后开始形成由颗粒样细胞组成的空卵泡样结构——尽管事实上没有卵细胞存在。到第70天,类卵巢内形成了许多不同大小的卵泡,其中一些已经发展出具有成熟卵泡特征的多层(multiple layers),以支撑卵子。
该论文的资深作者、哈佛医学院遗传学教授Church表示:“这本身就是一项壮举——该人类卵巢类器官(human ovaroids)可以高效复制人类卵巢中可见的激素信号传导、生殖细胞成熟和卵泡形成;更值得一提的是,这些可以在短短五天内完成;而人/小鼠杂交卵巢类器官所需一个月的时间来完成。这无疑将会大大加快有关女性健康和生殖问题的研究。”
Wyss团队正在继续开发人类卵巢类器官模型,并计划整合其他卵巢细胞类型——包括产生激素的膜细胞——以便更充分地复制人类卵巢的复杂功能。他们还希望改进他们的培养系统,让生殖细胞充分发育成卵细胞,并确定不同TF的较佳剂量。同时,Gameto公司已与一些领先的临床机构开始了临床前研究,以探索人类卵子成熟所需的衍生共培养系统(derived co-culture system)。
Wyss创始董事、哈佛医学院及波士顿儿童医院教授Don Ingber表示:“一半的人口是女性,但从历史上看,对女性健康的关注和投资并没有与男性那样平等。我很高兴看到能够在实验室研究人类卵巢方面迈出这重要一步,并期待这样的模型能为女性生殖健康和疾病提供突破性见解。”
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com