当一款药物未上市时,适应症布局、开发进度、临床数据等都是衡量其商业潜力的重要因素。而当药品上市后,销售业绩几乎就是检验其商业价值的标准。对于企业来说,药品获得监管机构批准进入市场固然可喜可贺,但这只是万里长征的第一步,如何在市场竞争中证明自己同样至关重要。
2022年,FDA的药品评价与研究中心(CDER)共批准了37款新药,包括22款新分子实体和15款生物制品。此外,生物制品评价和研究中心(CBER)还批准了2款疫苗、1款细胞疗法和4款基因疗法,以及1款微生物组疗法。(见:2022年FDA批准的新药)
随着各大药企2022年财报的披露,部分在2022年上市新药的销售额也浮出了水面。
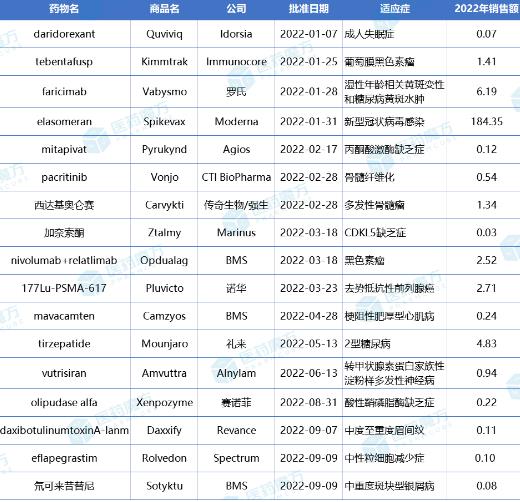
2022年获FDA批准的部分新药销售额(亿美元)
注:1美元=0.95397瑞士法郎;1美元=0.94847欧元;1美元=0.8076英镑(2022年平均汇率)
整体来看,虽然大多数产品都还未经历过一个完整年度的市场检验,但已经有部分品种显示出重磅炸弹的潜力,市场想象空间巨大。
其中,值得一提的就是罗氏的Ang2/VEGF-A双抗Vabysmo(faricimab)和礼来的GLP-1R/GIPR双重激动剂Mounjaro(tirzepatide)。
Vabysmo是15年来湿性年龄相关黄斑变性(wAMD)患者的一个创新机制疗法,也是近10年来糖尿病黄斑水肿(DME)患者的一个创新疗法。与现有眼科药物阿柏西普(每2个月1次)和Beovu(brolucizumab,每3个月1次)相比,Vabysmo可将用药频率降低至每4月1次,极大提高了患者的依从性。得益于良好疗效和用药便利,Vabysmo上市首年就收入6.19亿美元,超过了诺华的Beovu(2022年销售额2.03亿美元)。
Mounjaro是近十年来一个获批的新型糖尿病药物,被礼来寄予厚望,上市半年多斩获4.83亿美元的销售额。美洲银行分析师预测,随着Mounjaro心力衰竭、NASH、肥胖等8种适应症在各国的获批,2032年它甚至可能成为一个年销售额达1000亿美元的药物。
此外,2022年FDA批准的新药创新含量极高,仅CDER批准的37款新分子实体中就有20款为“first-in-class”疗法。如果将“天选之子”Spikevax与“学神”Vabysmo和Mounjaro排除在外,余下的创新疗法中亦涌现出了不少“绩优生”。
具体来看,全球一款TCR疗法Kimmtrak虽然受限于HLA-A*02:01阳性转移性葡萄膜黑色素瘤患者人群的狭小,但上市近1年凭借自身的创新性依旧销售了1.41亿美元。还有RNAi疗法Amvuttra被批准用于转甲状腺素蛋白家族性淀粉样多发性神经病,不到半年给Alnylam带来了0.94亿美元的收入。
Carvykti是中国一个成功出海的国产CAR-T细胞疗法,也是全球第2款获批的BCMA CAR-T,来自于传奇生物。在强生的助推下,Carvykti上市首年累计销售1.34亿美元,也算交出了一份不错的答卷。(见:市场规模超27亿美元!天价CAR-T群雄逐鹿,一款重磅炸弹成功出世)
2022年3月上市的一款肺癌新辅助疗法Opdualag(PD1+LAG3)也收获了2.52亿美元,同月获批的一个用于治疗转移性去势抵抗性前列腺癌 (mCRPC)的靶向放射性配体疗法Pluvicto销售2.71亿美元。
其实,影响一款新药销售额的因素有很多,包括适应症人群、同类产品竞争程度、公司商业化能力、上市时间、支付方式等。上市首年的业绩并不能代表这款新药以后的市场表现,未来随着适应症拓展、市场渗透等,期待更多新药交出亮眼的市场答卷。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com