中山大学附属第三医院揭示肝细胞癌免疫治疗新策略
近日,中山大学附属第三医院研究团队在期刊《Journal of Experimental & Clinical Cancer Research》上在线发表题为“Blockage of CacyBP inhibits macrophage recruitment and improves anti-PD-1 therapy in hepatocellular carcinoma”的研究论文,研究结果表明,CacyBP有潜力成为提高肝细胞癌对抗PD-1免疫治疗敏感性的重要靶点,为肝细胞癌免疫治疗提供了潜在策略。
研究背景
由于肝细胞癌隐匿的发病机制和快速的进展,相当比例的肝细胞癌患者常常在晚期被诊断,因此不适合接受根治性手术治疗。系统性分子药物已成为晚期肝细胞癌的主要治疗方法,如仑伐替尼和索拉非尼已被证实可将肝细胞癌患者的中位总生存期延长11-14个月。然而,这些药物的治疗效果仍然受到原发性和继发性耐药现象的限制。
免疫检查点抑制剂(ICIs),尤其是程序性细胞死亡蛋白-1(PD-1)和程序性死亡配体-1(PD-L1)检查点阻断,已成为一种有前景的抗癌治疗模式。尽管免疫检查点抑制剂在某些癌症治疗中取得了一定的疗效,但两项临床试验显示,仅约15-20%的肝细胞癌患者对抗PD-1单药治疗表现出持久的反应。因此,迫切需要阐明肝细胞癌对免疫检查点抑制剂耐药的潜在机制,以改善临床疗效。
肿瘤相关巨噬细胞(TAMs)是肝细胞癌微环境中丰富的免疫细胞之一。越来越多证据表明,TAMs的高密度与许多癌症,包括肝细胞癌在内的恶劣预后相关联。通常情况下,肿瘤相关巨噬细胞被引导进入肿瘤环境,并随后受肿瘤细胞释放的细胞外囊泡和细胞因子的教育,建立起免疫抑制性肿瘤微环境,这对于细胞间的通讯至关重要。这些浸润的巨噬细胞也可通过释放细胞因子或直接相互作用影响肿瘤细胞,终导致免疫逃逸和肿瘤进展。因此,阻断TAM的招募和浸润可能是一种有前景的癌症治疗策略。
CacyBP/SIP(钙结合蛋白和Siah-1相互作用蛋白)是一种多配体蛋白,早在厄利希腹水瘤细胞中被发现。CacyBP在不同的哺乳动物细胞中广泛表达,并通过与多个靶蛋白结合参与各种生物过程。尽管文献揭示了CacyBP在许多癌症中的过表达及其与不良预后的关联,但CacyBP表达对免疫微环境的影响,特别是对调节肿瘤相关巨噬细胞的影响,仍未明确定义。
研究发现
在研究中,研究人员通过使用免疫印迹和免疫组化技术,证明了CacyBP在HCC组织中与Myd88的表达呈正相关。研究人员发现CacyBP通过破坏其与E3连接酶Siah-1的相互作用,保护Myd88免受泛素化和蛋白酶体降解的影响。此外,抑制CacyBP-Myd88轴会通过减少CX3CL1的分泌而影响TAMs对肿瘤微环境的招募,并使HCC患者对抗PD-1治疗产生敏感性。研究人员的发现为CacyBP在肿瘤微环境调节中的作用提供了新的见解,并为肝细胞癌免疫治疗提供了潜在策略。
阻断CacyBP可以增强抗PD-1
抗体在肝细胞癌治疗中的疗效
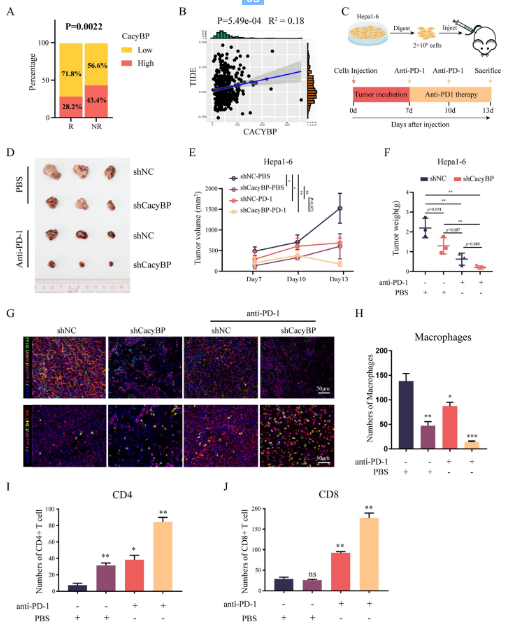
已知TAM的浸润在诱导免疫耐受和抗PD-1治疗耐药中起到一定作用。为了进一步探索CacyBP抑制是否可以改善免疫治疗的疗效,研究人员使用TIDE算法预测了CacyBP表达与肝细胞癌患者抗PD-1治疗反应之间的相关性。HCC患者中CacyBP表达较低的群体显示出较低的TIDE得分,这意味着这些患者可能对抗PD-1治疗更为敏感。研究人员通过在C57BL小鼠皮下植入shNC或shCacyBP Hepa1-6细胞来建立异种移植肿瘤模型,并分别对小鼠进行抗PD-1或对照同位素抗体处理。
与先前的发现一致,抑制CacyBP会抑制肿瘤生长并减少F4/80+CD163+巨噬细胞的肿瘤浸润。与此同时,抗PD-1抗体的叠加不仅进一步抑制了肿瘤生长和巨噬细胞浸润,还恢复了驻地T细胞的抗肿瘤活性。在所有组中,shCacyBP加上抗PD-1治疗的组合实现了较佳的抗肝细胞癌疗效。这些结果表明CacyBP有潜力成为提高肝细胞癌对抗PD-1免疫治疗敏感性的重要靶点。
研究结果
综上所述,研究结果表明,CacyBP有潜力成为提高肝细胞癌对抗PD-1免疫治疗敏感性的重要靶点,为肝细胞癌免疫治疗提供了潜在策略。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com