这个新靶点,让CAR-T细胞治疗实体瘤和脑肿瘤更进一步
CAR-T细胞疗法是一种革命性的癌症治疗新技术,自2017年以来,美国FDA已经批准了六种CAR-T细胞疗法用于治疗恶性血液类癌症,并展现了令人印象深刻的治疗效果。
但CAR-T对实体瘤和脑肿瘤的治疗效果受到多种因素的阻碍,包括CAR-T细胞的扩增和持久性有限、免疫抑制性肿瘤微环境,以及缺少肿瘤特异性抗原等等。此外,在临床前和临床研究中观察到的on-target/off-cancer毒性(即靶向了在肿瘤外的正常组织表达的抗原),强调了识别在广泛肿瘤上表达的肿瘤特异性抗原的必要性。
近日,圣裘德儿童研究医院的研究人员在 Cell 子刊 Cell Reports Medicine 上发表了题为:GRP78-CAR T cell effector function against solid and brain tumors is controlled by GRP78 expression on T cells 的研究论文。
该研究验证了靶向GRP78的CAR-T细胞在多种脑肿瘤和实体瘤中具有治疗效果。该研究还发现了肿瘤的一种耐药机制,一些肿瘤细胞会诱骗CAR-T细胞达GRP78,从而让它们自相残杀。因此,GRP78-CAR-T细胞对脑肿瘤和实体瘤的效应功能受T细胞上GRP78的表达水平调控。
这项研究验证了GRP78作为细胞治疗新靶点的潜力,对于开发靶向高表达GRP78的多种难治性脑肿瘤和实体瘤的免疫疗法具有重要意义。
通过对T细胞进行重编程,构建出选择性靶向和杀死肿瘤细胞、但不伤害健康组织的CAR-T细胞,在白血病等血液类肿瘤中展现了强大的治疗效果。但该方法对实体瘤和脑肿瘤效果不佳,其中一大原因是实体瘤中难以找到肿瘤特异性抗原。
为了提高CAR-T细胞疗法在实体瘤和脑肿瘤中的治疗潜力,研究团队将目标放在了一个新靶点上——细胞表面GRP78(csGRP78)。
GRP78是一种关键的未折叠蛋白反应(UPR)调节因子,通常位于内质网中,在几种实体瘤和脑肿瘤中高表达(包括成人胶质母细胞瘤、弥漫性内在脑桥胶质瘤、骨肉瘤、三阴性乳腺癌和尤文肉瘤),当内质网应激升高时,GRP78过表达并易位到癌细胞表面。作为一种常见的必需基因,GRP78不易受抗原丢失的影响。此外,GRP78在肿瘤细胞中的细胞表面异位是由多种机制驱动的,这降低了免疫逃逸的可能性。所有这些特征使GRP78成为实体瘤和脑肿瘤治疗中具有吸引力的靶抗原。
研究团队构建了靶向GRP78的CAR-T细胞(GRP78-CAR-T细胞),并在细胞和小鼠模型中成功地杀死了多种类型的癌症,包括急性髓系白血病(AML)、成人胶质母细胞瘤(aGBM)、弥漫性内在脑桥胶质瘤(DIPG)、骨肉瘤(OS)、三阴性乳腺癌(TNBC)和尤文肉瘤(EWS)。
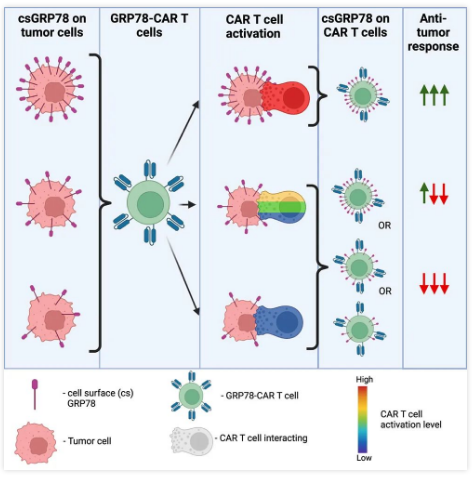
研究团队一开始推测,更高水平的GRP78将使CAR-T细胞更容易定位和摧毁癌症,然而,事实并非如此,他们发现,肿瘤细胞表面表达的GRP78水平与CAR-T细胞杀死癌细胞的能力之间似乎没有关系。
研究团队进一步探索了这一现象背后的原因,GRP78-CAR-T细胞在所有测试的肿瘤中表现出不同程度的抗肿瘤活性,这种活性可能依赖于T细胞表面GRP78的表达。
某些肿瘤细胞会改变T细胞激活和T细胞的GRP78表达,这些肿瘤细胞使靶向GRP78的CAR-T细胞的表面也表达了GRP78,T细胞表面表达的GRP78越多,它们就越不活跃,降低了其杀癌活性。此外,仍然活跃的CAR-T细胞会靶向并杀死了表面表达GRP78的同类。 也就是说,肿瘤细胞能够欺骗CAR-T细胞,让它们自相残杀,从而让自己逃过一劫。
通过这些实验,研究团队揭示了GRP78的复杂性。由于它存在于许多难以治疗的肿瘤类型中,GRP78仍然是一个诱人的癌症治疗靶点,但我们还需要扩大其与T细胞的相互作用的理解,以使靶向GRP78的免疫疗法可行,如果可行可以,靶向GRP78的CAR-T细胞可能成为一种适用于多种癌症类型的细胞疗法。
研究团队表示,我们总是需要找到新靶点来改善癌症治疗,从生物学角度来看,GRP78是一个具有潜力的新靶点,但它又与之前的癌症相关分子不同。这项研究表明,对于下一代CAR-T细胞疗法的开发,我们需要认识到,并不是所有的靶点都是平等的。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com