浙江大学梁廷波团队发现通过免疫化疗“根除”胰腺癌的机制
2024年1月4日,浙江大学梁廷波及白雪莉共同通讯在《Autophagy》在线发表题为“Targeting cancer-associated fibroblast autophagy renders pancreatic cancer eradicable with immunochemotherapy by inhibiting adaptive immune resistance”的研究论文,研究揭示了CAF自噬的抑制在免疫缺陷异种移植模型中抑制体内肿瘤发展。这种缺陷削弱了体外和体内抗肿瘤免疫和抗肿瘤效果,通过在免疫能力的小鼠模型中上调CD274/PDL1水平。
研究背景
众所周知,胰腺导管腺癌 (PDAC) 对化疗、靶向治疗甚至免疫治疗具有耐药性,这主要是由于丰富的结缔组织增生和免疫抑制性肿瘤微环境 (TME)。因此,迫切需要确定新的治疗方法来重塑TME,以改善这种疾病的预后。
多个免疫检查点(ICB)疗法的临床试验已经启动,作为黑色素瘤、肺癌和肾癌的治疗手段,并取得了令人鼓舞的临床结果。然而,由于自适应免疫耐药(AIR)的存在,预计平均有25%的实体瘤患者对ICB疗法产生反应。基于CD274/PDL1表达和肿瘤浸润淋巴细胞(TILs)(主要基于CD8+ T细胞),肿瘤可分为四类:CD274− TIL−(I型);CD274+ TIL+(II型);CD274− TIL+(III型)和CD274+ TIL−(IV型)。对于TIME类型I、III和IV的实体瘤患者观察到抗CD274、抗PDCD1/CD279疗法的差劲反应。由于胰腺癌存在大量增生和免疫抑制的TME,大多数胰腺癌属于I型和IV型。因此,ICB疗法迄今在PDAC中显示出有限的有效性。从理论上讲,一个有吸引力的策略是将TIME类型(I、III和IV)转变为II型,使它们对胰腺癌的抗CD274、抗PDCD1/CD279疗法产生敏感性。
癌相关成纤维细胞(CAFs)在促进结缔组织增生和免疫抑制 TME 中起着至关重要的作用,因此代表了癌症的潜在治疗靶点。自噬是一种多步调节机制,通过该机制将细胞物质输送到溶酶体进行降解,并支持营养循环和代谢适应。在免疫微环境之外,CAF自噬对结缔组织增生的影响已经在前面进行了描述。然而,CAF自噬在免疫监视和癌症免疫治疗中的作用仍然未知。
研究结果
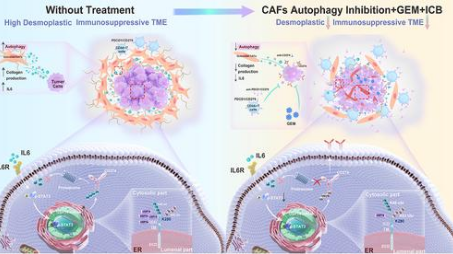
本研究,我们报道了在PDAC中,CAF自噬在免疫调节和免疫治疗中比肿瘤细胞本身的自噬起着更重要的作用。具体而言,CAF的遗传和化学自噬抑制将TME的I型和IV型转化为II型,因此在免疫功能正常的小鼠模型中增强ICB和吉西他滨治疗的疗效是有意义的。
总之,我们的研究结果表明,CAF 自噬的缺失降低了 IL6 的产生水平,破坏了结缔组织增生,并降低了胰腺癌细胞中 USP14 表达转录的水平。事实上,我们通过去除 K280 残基处的 K63 连接泛素化,将 USP14 确定为上调 CD274 表达的翻译后因子。在功能上,自噬缺陷的CAFs提高了抗PDCD1/CD279抗CD274和吉西他滨治疗胰腺癌的免疫活性小鼠模型的疗效(图8)。
图8,胰腺癌中CAF自噬-IL6-USP14-CD274信号通路的预测模型。研究人员提出了一个示意图模型来说明CAF自噬如何调控胰腺癌中的肿瘤免疫监视和结缔组织增生TME。因此,靶向CAF自噬提高了胰腺癌免疫化疗的疗效。
研究结论
综上所述,我们揭开了一个关于胰腺癌的有趣而创新的故事:CAFs的激活通过自食增强物理屏障,阻断抗肿瘤药物和免疫细胞的浸润,使肿瘤高度泛素化,导致胰腺癌CD274的“靶点缺失”,进一步形成胰腺癌的免疫沙漠,避免被CD8+T细胞杀死。简而言之,吃CAFs的自身是为了不被肿瘤细胞吃掉。因此,破坏CAFs的“自我牺牲”为进一步的临床试验铺平了道路,以评估其对PDAC患者的临床影响。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com