厦门大学发现血管病靶向治疗新策略
1月17日,厦门大学研究团队在期刊《Cell Death Discovery》上发表了题为“NMDARs activation regulates endothelial ferroptosis via the PP2A-AMPK-HMGB1 axis”的研究论文,本文中,研究人员证明了NMDAR通过PP2A-AMPK-HMGB1途径调控铁死亡在内皮细胞损伤中的新作用。
研究背景
血管内皮细胞(VECs)位于富氧的血管环境中,通过调节血管舒张、收缩、生长抑制和生长促进的平衡以及抗炎或促炎作用,对支持血管的结构和生物功能、维持血管张力至关重要。VEC功能障碍可能导致动脉硬化和血栓闭塞性脉管炎等心血管疾病,这些疾病与心血管危险因素密切相关。与动脉硬化不同,内皮功能障碍也可以逆转。因此,应早期预防和治疗,以预防血管疾病。铁死亡是一种新型的调控细胞死亡,于2012年被首次报道。它是一种铁依赖的脂质过氧化反应,在生化上与其他形式的细胞死亡,如坏死、凋亡和焦亡不同。研究发现,细胞铁死亡的增加进一步加剧了许多疾病的功能损伤,如缺血性疾病、肿瘤和组织损伤,包括创伤性脑损伤、神经退行性疾病、叶酸诱导的肾损伤和CAD。然而,在NMDAR激活条件下,铁死亡在内皮细胞功能和血管功能障碍中的作用尚未被探讨。
研究发现
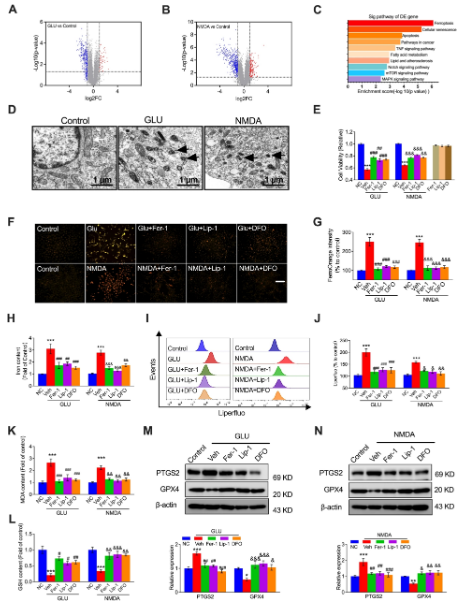
在本研究中,研究人员发现L-谷氨酸(GLU)或NMDA激活NMDAR通过增加铁含量、MDA和PTGS2的表达来促进铁死亡,并降低GPX4的表达,这被铁死亡抑制剂Fer-1、Lip-1或DFO逆转。PP2A-AMPK-HMGB1通路是与NMDAR激活诱导的铁死亡相关的主要通路,这通过PP2A抑制剂LB-100、AMPK激活剂AICAR或HMGB1 siRNA得到验证。NMDAR在铁死亡中的作用通过铁死亡激活剂Erastin或RSL3得到验证,这被NMDAR抑制剂MK-801抵消。体内实验结果显示,MK-801、LB-100、AICAR、MK-801和GLY逆转了NMDA或GLU诱导的铁死亡,证实了PP2A-AMPK-HMGB1通路参与了NMDAR激活诱导的血管内皮铁死亡。本研究证明了NMDAR通过PP2A-AMPK-HMGB1通路调节铁死亡在内皮细胞损伤中的作用。
铁死亡参与NMDAR激活介导的血管内皮细胞损伤
另外,已有报道指出,PP2A/AMPK通路参与了铁死亡。AMPK调节代谢、线粒体稳态和自噬。当葡萄糖缺失时,它被激活,开启了针对铁死亡的能量应激保护程序,涉及多不饱和脂肪酸的生物合成受损,这对于脂质过氧化驱动的铁死亡至关重要。本研究通过PP2A/AMPK/HMGB1通路激活NMDAR,发现了AMPK在铁死亡中的一个新作用。研究人员证明,在NMDAR激活后,通过去磷酸化PP2Ac上的Tyr307位点来激活PP2A,并进一步去磷酸化AMPK以增加HMGB1表达诱导HUVECs的铁死亡。
研究结论
铁死亡是血管内皮细胞死亡的一种表现形式,其发生机制与血管内皮细胞死亡有关,但具体机制不同,AMPK信号通路在一定程度上介导了铁死亡过程。本研究证实NMDA和GLU激活PP2A,抑制AMPK,进而促进HMGB1,介导铁死亡。本研究探讨了NMDAR激活诱导血管内皮细胞铁死亡的机制,并对部分结论进行了体内验证,旨在为血管内皮细胞死亡的治疗提供新的视角,为开发新的抗血管内皮铁死亡药物提供具体的理论基础和思路。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com