达雷妥尤单抗皮下注射制剂申报新适应症,治疗新诊断多发性骨髓瘤
1月30日,强生宣布已向FDA提交达雷妥尤单抗皮下注射制剂(商品名:Darzalex Faspro)的补充生物制品许可申请(sBLA),用于联合硼替佐米、来那度胺和地塞米松(D-VRd)作为适合接受自体干细胞移植(ASCT)的新诊断多发性骨髓瘤成人患者的诱导治疗和巩固治疗,然后联合来那度胺(D-R)作为这类患者的维持治疗。
此次sBLA主要是基于III期PERSEUS研究的积极结果。该研究是一项随机、开放标签临床试验(709),评估了D-VRd和VRd作为诱导治疗和巩固治疗而后D-R和来那度胺(R)作为维持治疗的有效性和安全性。研究的主要终点是PFS。
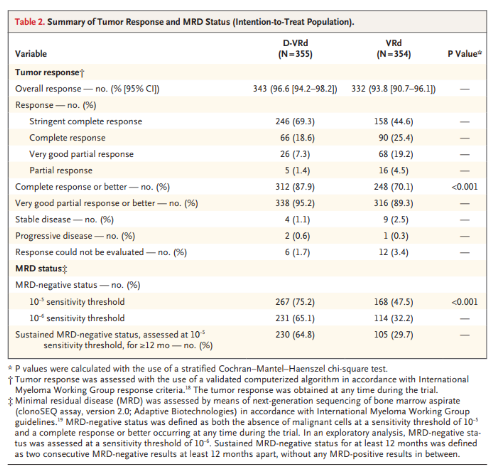
初步分析结果显示,患者接受D-VRd作为诱导治疗和巩固治疗而后D-R作为维持治疗后,疾病进展或死亡风险降低了58%(HR=0.42;95%CI: 0.30-0.59;P<0.0001)。相比于接受VRd作为诱导治疗和巩固治疗而后R作为维持治疗的患者,D-VRd+D-R组患者的应答程度、完全缓解率(CRR)、严格完全缓解率(sCRR)和微小残留病变(MRD)阴性率均更高。
PERSEUS研究疗效数据(来源:NEJM)
安全性方面,达雷妥尤单抗组有34例患者死亡。常见的不良事件是中性粒细胞减少(62.1%)和低血小板计数(29.1%)。严重不良事件发生率为57.0%。
达雷妥尤单抗是全球一款获批上市的CD38单抗,可直接与骨髓瘤细胞表面重要的免疫治疗靶点CD38特异性结合,通过多重机制诱导骨髓瘤细胞死亡,达到快速缓解的治疗效果。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com