同济大学徐美东/陈涛团队发现食管鳞癌靶向治疗新策略
2月27日,同济大学附属东方医院徐美东教授、陈涛教授研究团队在期刊《Cell Death Discovery》上发表了研究论文,题为“IGF-1-mediated FOXC1 overexpression induces stem-like properties through upregulating CBX7 and IGF-1R in esophageal squamous cell carcinoma”。研究显示,在食管鳞癌(ESCC)中FOXC1表达明显上调,与预后不良相关。FOXC1的下调对ESCC的肿瘤发生、增殖和对化疗药物的耐受性具有抑制作用,同时降低了干细胞相关标志物CD133和CD44的水平。进一步的研究证实FOXC1通过反激活CBX7和IGF-1R诱导ESCC干细胞。综上,靶向IGF-1-FOXC1-IGF-1R轴成为食管鳞癌抗CSC治疗的一种有前途的方法。
研究背景
食管癌是全球癌症相关死亡的主要原因,食管鳞状细胞癌是其主要的组织学亚型。内镜下粘膜剥离术是世界上诊断频率第6高、死亡率第4高的癌症,已成为早期食管鳞状细胞癌首选的微创治疗方法,可改善患者预后。然而,随着疾病进展,治疗出现复杂性,导致预后减少和死亡率升高。早期食管癌的存活率超过90%,但进入晚期后,存活率急剧下降到不到5%。这些统计数据强调了早期发现和治疗食管鳞状细胞癌的关键作用。因此,有必要探索食管鳞状细胞癌进展的分子机制,并确定阻碍其进展的潜在靶点。
肿瘤干细胞具有自我更新和维持干细胞状态的能力,对肿瘤的形成、维持、进展和耐药有重要作用。因此,靶向与这些癌症干细胞相关的信号通路是一种很有前途的癌症治疗策略。
研究进展
在本研究中,研究人员首次揭示了FOXC1参与ESCC干性调控。CD133和CD44是ESCC的典型肿瘤干性标志物。研究人员发现FOXC1的下调在蛋白和mRNA水平上显著降低了CD44和CD133的表达,随后减少了食管癌细胞系ECA-109和KYSE-150中CD44+细胞的比例。此外,在FOXC1基因敲低组中,象征自我更新的球体形成能力(CSC的关键特征之一)显著下降,与对照组相比,球体明显变小。
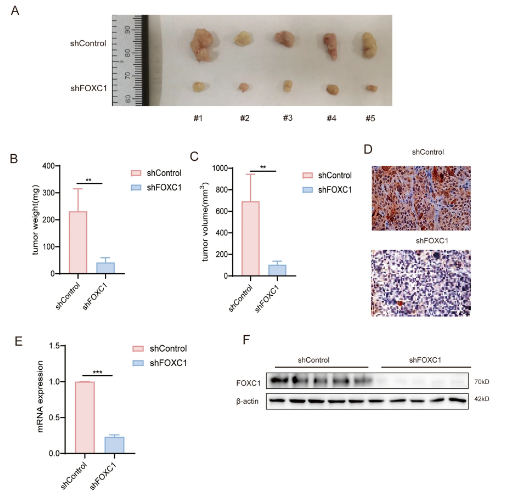
此外,在体外和体内,干细胞性对肿瘤细胞增殖都有影响。FOXC1敲低导致FOXC1敲低组的生长速度减慢,这从CCK8试验中可以看出,并且与对照组相比,体内肿瘤大小和体重差异也证实了这一点。
耐药是食管鳞状细胞癌治疗的关键挑战,也是肿瘤干细胞的重要特征。虽然化疗药物以肿瘤细胞为靶点,但CSCs对化疗的耐受能力强,导致肿瘤复发。顺铂作为食管鳞癌化疗的基石,正面临耐药性挑战。FOXC1基因沉默增强了肿瘤细胞对顺铂的敏感性,提示FOXC1可能成为食管癌治疗的生物标志物和耐药靶点。
FOXC1增强ESCC细胞在体内的致瘤性
研究结论
总之,本研究结果表明,IGF-1介导FOXC1表达,而FOXC1上调CBX7和IGF-1R表达并诱导ESCC干性。因此,FOXC1成为一个潜在的预后指标,而IGF-1-FOXC1-IGF-1R致癌环路成为缓解FOXC1诱导的ESCC干性的有前途的治疗途径。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com