宁波大学新研究:发现“癌中之王”胰腺癌耐药机制和预后靶点
近日,宁波大学研究团队在期刊《Cell Death Discovery》上在线发表题为“LncRNA MACC1-AS1 induces gemcitabine resistance in pancreatic cancer cells through suppressing ferroptosis”的研究论文,本研究发现了一种新的细胞内信号通路,在胰腺癌的吉西他滨耐药中发挥作用。通过一系列的探索和验证,这一发现可能为未来临床应用提供新的见解和理论基础。
研究背景
胰腺癌是一种罕见的恶性肿瘤,仅占所有癌症病例的2%–3%。然而,它与7%的显著高死亡率相关。目前,吉西他滨是胰腺癌常用的化疗药物。遗憾的是,吉西他滨治疗胰腺癌的总体缓解率低于20%,80%的患者在1年内复发并死亡。尽管吉西他滨在晚期转移患者中具有一定效果,但其结果并不令人满意,这主要归因于耐药性的发展。
铁死亡是一种铁依赖性、脂质过氧化物积累驱动的调节性细胞死亡过程。研究表明,胰腺癌细胞利用与铁死亡相关的抗氧化系统来清除活性氧(ROS),作为逃避细胞死亡的策略。Nrf2-ARE通路在细胞抗氧化应激反应中发挥重要作用。此外,Keap1-Nrf2通路通过调节下游靶基因SLC7A11的表达水平抑制铁死亡。
大量研究强调了非编码RNA,如microRNA(miRNA)和长链非编码RNA(lncRNA)在铁死亡调控中的作用。其中,MACC1-AS1已被确认为MACC1 mRNA的反义RNA。研究表明,MACC1-AS1通过腺苷活化蛋白激酶/Lin28通路稳定MACC1的表达水平,促进细胞行为,包括胃癌细胞的增殖和侵袭。尽管一些lncRNA与胰腺癌细胞的耐药性有关,但目前还没有关于MACC1-AS1与胰腺癌细胞耐药关系的研究。
研究进展
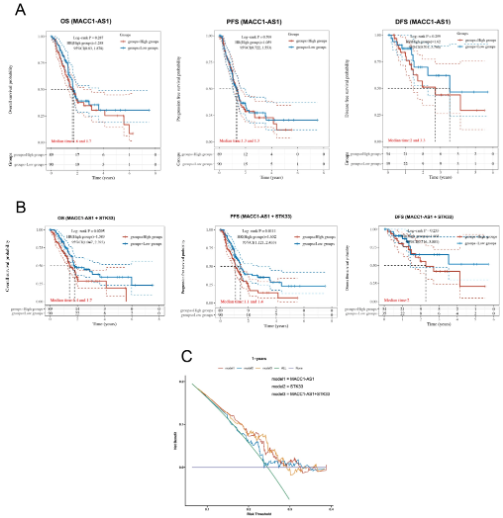
在临床应用方面,尝试分析了胰腺癌患者中MACC1-AS1、STK33以及两者基因的表达水平及其预后意义。首先将患者分为高风险组和低风险组。然后,展示了两组的生存状态,并显示了热图,代表MACC1-AS1和MACC1-AS1+STK33的基因表达水平。KM生存曲线显示,高风险组的患者与低风险组的患者在OS、PFS和DFS率方面具有不同的中位生存时间。结果显示,MACC1-AS1的高表达表明胰腺癌患者OS、PFS和DFS的生存时间较差,但无统计学意义。然而,发现MACC1-AS1和STK33的组合对OS和PFS率均有显著影响。结果表明,MACC1-AS1和STK33的联合分析在OS和PFS方面呈现出统计学意义(P < 0.05),而对DFS仍然没有意义。
此外,与单独使用基因表达相比,这种联合方法表现出更优越的性能。建立了MACC1-AS1、STK33和两者的决策曲线分析(DCA),计算了每位患者的风险评分,并使用“ggDCA” R软件包获得了不同的DCA模块。患者被分为五个模块。根据DCA分析结果,MACC1-AS1和STK33的联合预后效果表现出更高的DCA值,表明多基因模型对1年OS具有更强的预测能力。这些数据表明,MACC1-AS1和STK33可以作为胰腺癌患者临床预后的联合靶点。
研究结论
综上所述,本研究发现了一种新的细胞内信号通路,在胰腺癌的吉西他滨耐药中发挥作用。通过一系列的探索和验证,这一发现可能为未来临床应用提供新的见解和理论基础。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com