中山大学发文:揭示乳腺癌靶向治疗新策略
3月16日,中山大学研究人员在期刊《Advanced Science》上发表了研究论文,题为“Activation of Bivalent Gene POU4F1 Promotes and Maintains Basal-like Breast Cancer”。本研究结果揭示了亚型特异性表观遗传激活的TF在促进和维持BLBC中起关键作用,表明POU4F1是BLBC的潜在治疗靶点。
研究背景
乳腺癌是全球常见的癌症,2020年超越肺癌。基底细胞样乳腺癌(BLBC)占乳腺癌的15%-20%,根据乳腺癌的转录程序进行分类,具有高增殖活性和细胞周期检查点失调的特点。大约75%的BLBC是三阴性乳腺癌(TNBC),不表达雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)。因此,内分泌治疗和HER2靶向治疗无效,手术和化疗仍然是主要的治疗方法。BLBC的固有侵袭性临床行为,加上缺乏有效的分子靶点,导致BLBC的预后不良。尽管BLBC的遗传信息丰富,但尚未发现BLBC的明确遗传致癌驱动因素。因此,探索BLBC的发生和发展机制对于发现新的治疗靶点至关重要。
转录失调是癌症的标志,可作为癌症发生和进展的重要驱动因素。越来越多的研究证实,转录失调程序可以由转录因子(TF)控制,这些转录因子是参与基因转录调控的关键蛋白质。有限的TFs在特定的癌症类型中过度活跃,代表了一种独特的药物靶标。例如,ERα是调节乳腺癌腔内表型的主要TF之一,也是内分泌治疗的关键靶标。然而,BLBC的主要TF及其潜在的调控机制仍不清楚。
研究发现
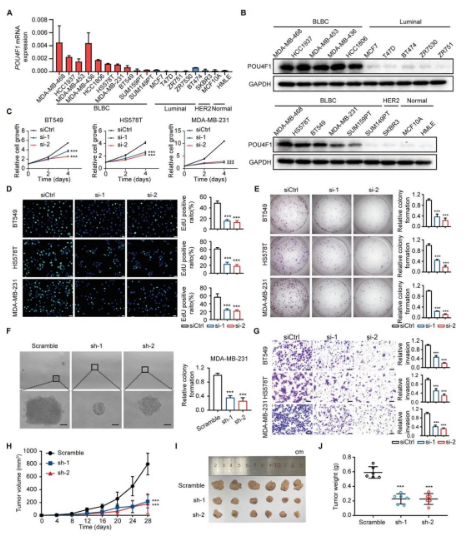
为了研究POU4F1在BLBC中的生物学功能,研究人员首先通过qRT-PCR和蛋白质印迹验证了POU4F1在BLBC细胞系中的独特高表达。然后通过两个独立的小干扰RNA(siRNA)在BLBC细胞系中沉默POU4F1,并使用qRT-PCR和蛋白质印迹验证沉默效率。通过CCK8细胞增殖实验和EdU实验确定,沉默POU4F1显著抑制BLBC细胞的生长。此外,沉默POU4F1在实验中均显著降低了BLBC细胞的克隆形成能力,并抑制了BLBC细胞的迁移和侵袭能力,但对BLBC细胞的凋亡没有影响。一致的是,过表达POU4F1增强了BLBC细胞的迁移和侵袭能力。
研究人员还将靶向POU4F1的shRNA稳定转导的MDA-MB-231细胞和非靶向对照shRNA分别接种到裸鼠的脂肪垫中。研究结果表明,POU4F1是BLBC肿瘤生长和恶性表型(包括增殖、集落形成、迁移和侵袭)所必需的。
POU4F1是BLBC恶性表型的必要条件
数据表明,POU4F1通过激活细胞周期相关通路,主要是G1/S相变,驱动BLBC恶性进展。
研究结果还表明,POU4F1通过CDK2/EZH2轴调节ERα表达。另外,靶向POU4F1不仅抑制了BLBC细胞的增殖和转移,而且通过ERα的重新表达和下游信号的再激活,使BLBC异种移植物对内分泌治疗敏感。
研究结论
总之,研究人员发现POU4F1是BLBC特异性过度活跃的TF,其表达与肿瘤生长和转移相关,导致患者不良预后,靶向POU4F1可抑制BLBC的恶性表型,并重新激活ERα表达,使其具有抗雌激素敏感性,因此,靶向POU4F1可能成为未来结合内分泌治疗BLBC的一种潜在治疗策略。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com