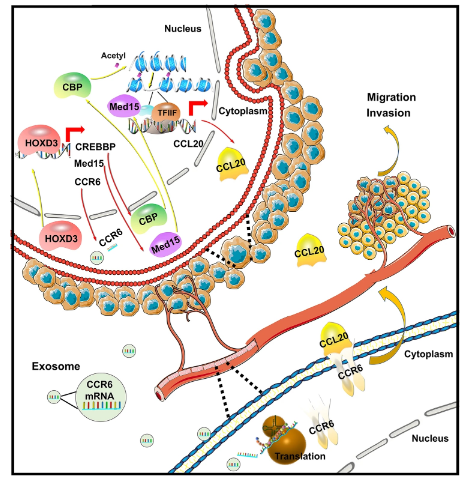
3月16日,西安交通大学王进海教授研究团队在期刊《Cell Death&Disease》上发表了研究论文,题为“HOXD3 promotes the migration and angiogenesis of hepatocellular carcinoma via modifying hepatocellular carcinoma cells exosome-delivered CCR6 and regulating chromatin conformation of CCL20”。本研究揭示了HOXD3-CREBBP / Med15-CCL20-CCR6轴在肝癌侵袭和迁移中的作用,为肝癌的治疗提供了前瞻性靶点。
研究背景
肝细胞癌是常见的癌症之一,也是癌症相关死亡的第二大原因。由于其发病率和死亡率的不断增加,肝癌已成为全球关注的健康问题。然而,肝癌的有效治疗方法有限。首选的治疗策略,即手术切除、放疗和化疗,都存在疾病复发的风险,导致预后不良。近年来,随着免疫学的进步,免疫治疗在肝细胞癌的治疗方面取得了重大进展。然而,免疫治疗药物价格昂贵,且具有毒副作用。因此,了解肝癌迁移和侵袭的分子机制,并确定其与基因表达调控的相关性,以提高肝癌的诊断和治疗,是非常重要的。
研究发现
在本研究中,研究人员证实了HOXD3-CCL20-CCR6轴在调节肝癌转移、迁移和内皮细胞血管生成中的作用,并发现HOXD3介导了肝癌和内皮细胞在TME中的串扰,因此推测HOXD3可能是一个有前途的治疗靶点。
研究人员研究了HCC来源的外泌体对HUVEC管形成和血管生成过程的影响。研究人员证明了HCC来源的外泌体circ-100338通过增加ECs的促血管生成活性来促进HCC的迁移。研究表明,来自HOXD3处理的HCC细胞(Huh7和MHCC-97H)的外泌体增强了HCC的迁移和侵袭。此外,使用3D球形发芽和管形成实验,结果表明,来自HOXD3处理的HCC细胞的外泌体增加了EC的血管生成。基于发现,研究人员推测CCR6通过HCC-HOXD3介导的外泌体转运促进EC血管生成,进而影响HCC迁移和侵袭。
研究结果还表明,CCR6表达与人类肝癌样本中的HOXD3呈正相关。HOXD3可以结合CCR6的启动子区域诱导其转录,而CCR6敲低则消除了HOXD3增强的肝癌转移和侵袭。因此,HOXD3可以通过上调CCR6的表达促进肝癌转移,而CCR6在肝癌和肝内胆管癌中发挥多种作用,协调肿瘤进展。
研究结果表明CCL20促进肝癌的转移、侵袭和内皮细胞的血管生成能力。这些结果在体内得到验证,抑制CCL20抑制了肝癌细胞的转移。此外,在肝癌细胞中观察到HOXD3和CCL20之间的正相关,并发现HOXD3靶向CREBBP和Med15的启动子区域。因此,研究人员推测HOXD3介导的CREBBP和Med15诱导的CCL20表达增加了肝癌细胞的迁移和侵袭能力。研究结果还表明CREBBP可以通过调控H3K27ac影响CCL20的染色质构象,导致CCL20表达增加。此外,研究人员还研究了HCC中Med15表达调控的机制。研究人员进一步研究了HCC中CCL20表达升高的调控机制。
HOXD3-CREBBP/MED15-CCL20-CCR6轴在HCC中作用的分子机制
研究结论
本研究发现,HOXD3处理的肝癌细胞外泌体通过传递CCR6 mRNA参与细胞间通讯,在体外和体内调节肝癌细胞的血管生成和转移、侵袭能力。此外,HOXD3直接调节CREBBP和Med15,后者通过促进H3K27乙酰化和诱导Pol II依赖性转录来增强CCL20的表达。CCR6和CCL20的协同作用通过在肝癌和肝癌细胞中发挥多种功能促进肿瘤进展。因此,本研究揭示了HOXD3-CREBBP/Med15-CCL20-CCR6轴在肝癌侵袭和迁移中的作用,从而为肝癌提供新的治疗靶点。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com