可有效消融肿瘤!中国科学技术大学揭示癌症免疫治疗新策略
3月16日,中国科学技术大学研究团队在期刊《ADVANCED SCIENCE》上在线发表题为“Enhancing Tumor Immunotherapy by Multivalent Anti-PD-L1 Nanobody Assembled via Ferritin Nanocage”的研究论文,本研究提出了一种使用多价纳米抗体-铁蛋白偶联物作为免疫靶向和增强载体来改善癌症免疫治疗的新策略。
研究背景
癌症免疫疗法是癌症治疗中一种引人注目的方法,通过激活免疫系统清除恶性细胞,实现持久的临床反应。在过去的十年里,基于单克隆抗体(mAb)的免疫检查点阻断(ICB)的发现极大地改善了癌症免疫疗法。特别是针对PD-1/PD-L1的单克隆抗体由于在临床治疗多种癌症方面取得成功而备受关注。然而,仅有一小部分患者(20-40%)从这种治疗中受益。T细胞对“冷癌”浸润不足通常与对ICB疗法的低免疫反应相关联。
为了解决这个问题,已经应用了一种适应性免疫应答策略,通过诱导免疫原性细胞死亡(ICD),导致肿瘤相关抗原(TAA)和损伤相关分子模式(DAMP)的释放。该过程促进树突状细胞(DCs)的成熟,并刺激肿瘤特异性T细胞的活化和浸润。在各种ICD策略中,光热疗法已成为一种很有前景的方法,通过将免疫学上的“冷肿瘤”转化为“热肿瘤”来唤起免疫反应。研究发现,轻度光热疗法(PTT)通过增加肿瘤浸润淋巴细胞的募集和增强T细胞对肿瘤的活性来增加PD-L1单克隆抗体的免疫治疗。
研究发现
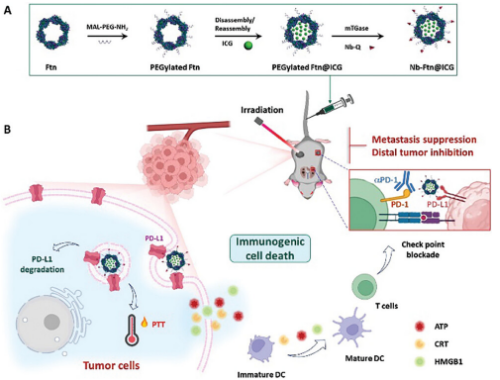
本研究中,研究人员使用抗PD-L1纳米体构建了用于癌症免疫治疗的Nb-Ftn纳米平台。抗PD-L1纳米体与铁蛋白位点特异性结合,靶向PD-L1过表达的肿瘤细胞。吲哚菁绿(ICG)是一种FDA批准的光热剂,被封装在用于PTT的铁蛋白腔中。这种纳米体铁蛋白纳米平台(Nb-Ftn@ICG)显示出多种益处,包括靶向积聚和保留在肿瘤组织中,激光照射后诱导肿瘤细胞的免疫原性死亡,树突状细胞和T细胞免疫反应的成熟,以及PD-L1的免疫检查点阻断和降解。纳米抗体-铁蛋白纳米平台通过整合PTT和免疫疗法的疗效,有效地消融了原发性治疗的肿瘤,抑制了未经治疗的肿瘤的生长,并减少了肺部肿瘤的转移,证明了这种方法在癌症治疗中的潜力。
研究结论
综上所述,本研究提出了一种使用多价纳米抗体-铁蛋白偶联物作为免疫靶向和增强载体来改善癌症免疫治疗的新策略。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com