复旦大学唐爽/宋少莉团队揭示非小细胞肺癌转移新机制
3月21日,复旦大学附属肿瘤医院唐爽/宋少莉教授团队在期刊《Advanced Science》上发表了研究论文,题为“Hypoxic Exosomal circPLEKHM1-Mediated Crosstalk between Tumor Cells and Macrophages Drives Lung Cancer Metastasis”。本研究中,研究人员通过系统分析非小细胞肺癌(NSCLC)细胞分泌的外泌体,发现了一种缺氧诱导的外泌体circPLEKHM1,它通过将巨噬细胞极化为M2型来驱动NSCLC转移。circPLEKHM1靶向治疗显著降低了体内NSCLC转移。本研究揭示了一种新的circRNA介导的机制,揭示了癌细胞如何在缺氧肿瘤微环境中与巨噬细胞相互作用以促进转移,并强调了外泌体circPLEKHM1作为肺癌转移预后生物标志物和治疗靶点的重要性。
研究背景
转移是癌症死亡的主要原因,涉及肿瘤细胞与肿瘤微环境(TME)之间的相互作用。肺癌是全球癌症相关死亡的主要原因。大约50%的晚期NSCLC患者发生骨转移,治疗选择非常有限。转移的治疗仍然是一项重大临床挑战。
缺氧和肿瘤浸润的免疫细胞是促进转移的潜在微环境因素。作为肿瘤微环境中的主要免疫细胞,巨噬细胞优先聚集在肿瘤的缺氧区域,在那里它们极化为M2型肿瘤相关巨噬细胞,并与肿瘤细胞进行交流,促进癌症进展和转移。然而,缺氧肿瘤微环境指示巨噬细胞调节癌症转移的机制仍未得知。 目前还缺乏阻断肿瘤细胞-巨噬细胞交流来对抗癌症转移的办法。
研究发现
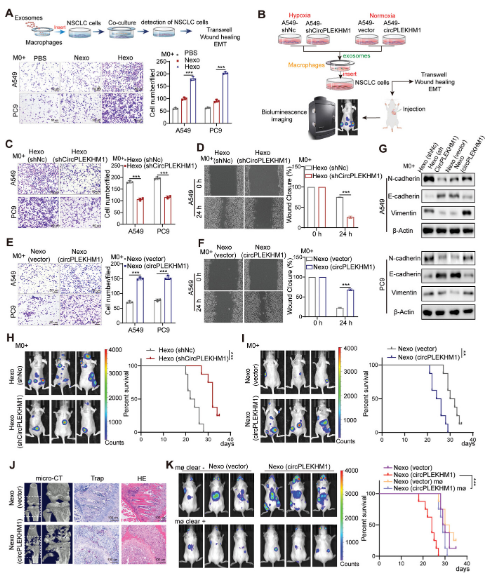
为了探讨缺氧诱导的外泌体在NSCLC转移中的作用,研究人员首先研究了这些外泌体是否能直接影响NSCLC细胞的迁移。与PBS对照相比,在缺氧诱导的外泌体中只观察到肿瘤细胞迁移的轻微增加,并且在缺氧和常氧外泌体中促进肿瘤细胞迁移的效果相当。这些结果表明,缺氧诱导的外泌体在癌细胞迁移过程中除了直接影响外,还可能发挥重要作用。研究还表明,缺氧外泌体预处理的巨噬细胞对NSCLC细胞迁移能力的增强作用较为显著,且可促进NSCLC细胞迁移,并上调NSCLC细胞中N-cadherin和波形蛋白的表达。这提示缺氧外泌体可通过巨噬细胞介导NSCLC细胞转移。
为了研究circPLEKHM1-ASO在体内的作用,研究人员通过心内注射给肺癌转移小鼠模型施用circPLEKHM1-ASO。结果表明,与对照组相比,circPLEKHM1-ASO治疗显著降低了肺癌转移并提高了总生存率,同时显著降低了转移浸润巨噬细胞中的circPLEKHM1水平。在另一肺癌骨转移的临床前小鼠模型中,获得一致结果,即circPLEKHM1-ASO治疗显著降低了NSCLC的骨转移。此外,体内微CT扫描显示,circPLEKHM1-ASO治疗显著减少了NSCLC荷瘤小鼠骨转移过程中的骨破坏,并增加了骨密度。与此一致的是,在circPLEKHM1-ASO治疗的小鼠肿瘤中发现了M2巨噬细胞标志物(CD206和CD115)表达和OSMR表达的显著降低。这证明,circPLEKHM1通过调节OSMR介导的巨噬细胞极化来促进NSCLC的转移。总之,circPLEKHM1-ASO在体内显著抑制了NSCLC转移并减少了肿瘤M2型巨噬细胞。
研究结果还表明,circPLEKHM1是通过OSMR介导的M2巨噬细胞抑制NSCLC转移的关键治疗靶点。
缺氧诱导的外泌体circPlEKHM1通过巨噬细胞促进NSCLC转移
研究结论
总之,研究人员发现外泌体circPLEKHM1作为一种在NSCLC中强有力的缺氧诱导转移促进环状RNA,作为NSCLC转移的预后生物标志物和治疗靶点。外泌体circPLEKHM1对TME中的缺氧做出反应,并作为癌细胞-巨噬细胞串扰的信使,通过增强PABPC1-eIF4G相互作用作为调节OSMR介导的M2巨噬细胞极化的关键支架来促进NSCLC转移。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com