中国科学院携手北京大学:发布新款mRNA癌症疫苗
3月25日,中国科学院与北京大学研究人员共同在期刊《Advanced Science》上发表了题为“All-Trans-Retinoic Acid-Adjuvanted mRNA Vaccine Induces Mucosal Anti-Tumor Immune Responses for Treating Colorectal Cancer”的研究论文。本研究中,研究人员开发了一款新的mRNA癌症疫苗,它可以通过使用脂质纳米颗粒(LNP)来共同传递全反式维甲酸(ATRA)和mRNA,从而刺激肠道中的黏膜免疫反应。与不含ATRA的常规mRNA-LNP相比,它显著提高了肿瘤抑制率,延长了动物生存期。总之,本研究为提高mRNA癌症疫苗对结直肠癌的治疗效果提供了一种有前景的方法。
研究背景
结直肠癌在所有癌症中发病率居第三位,死亡率居第二位。结直肠癌的主要治疗方法是手术切除、化疗、放疗和靶向治疗,但这些治疗后的复发率仍然很高。癌症免疫治疗代表了新一代癌症治疗,对治疗结直肠癌有很大的希望。作为另一类重要的免疫治疗药物,癌症疫苗利用宿主自身的免疫系统产生细胞毒性T细胞,可以特异性攻击和破坏癌细胞。基于细胞、病毒载体和多肽的癌症疫苗已经显示出良好的疗效,并进入临床阶段。随着两款针对新型冠状病毒肺炎(COVID-19)的mRNA疫苗获得批准,基于mRNA的癌症疫苗受到了广泛关注。mRNA疫苗具有多种优势,包括诱导体液和细胞免疫反应的能力、快速开发和制造的能力以及作为个性化癌症疫苗的潜力。早期开发mRNA癌症疫苗的尝试受到了mRNA高免疫原性、不稳定性和细胞摄取不良的阻碍。mRNA修饰和递送技术的进步为mRNA癌症疫苗的临床应用打开了大门。
研究进展
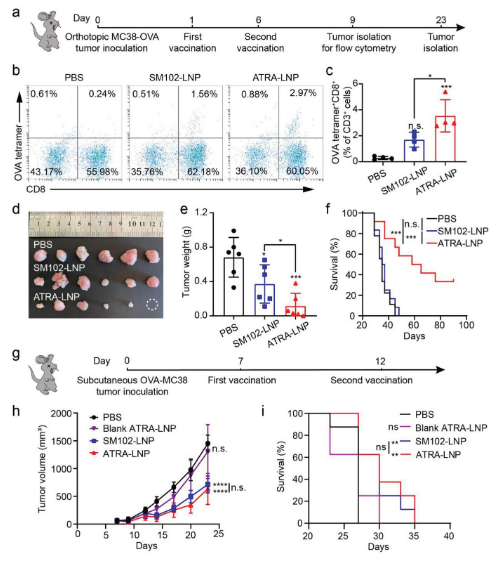
ATRA-LNP诱导细胞毒性T细胞进入肠道的能力使其成为治疗结直肠癌的有前途的治疗性疫苗。接下来,研究人员评估了ATRA-LNP作为治疗性疫苗在小鼠原位结直肠癌模型中的抗肿瘤效果。如图1b所示,与PBS治疗相比,SM102-LNP诱导了更高的OVA四聚体+CD8+CD3+T细胞数量,这表明mRNA疫苗在诱导抗肿瘤免疫反应方面总体上是有效的。ATRA-LNP处理诱导的OVA四聚体+CD8+CD3+T细胞分别是SM102-LNP和PBS处理的2.1倍和12.2倍。这些结果表明,LNP中的ATRA印记了肠道趋向的活化T细胞,并增加了抗原特异性、细胞毒性T细胞进入肿瘤微环境的浸润,这可能有助于更好地治疗肿瘤。的确如此,与SM102-LNP和PBS处理相比,ATRA-LNP处理显著降低了肿瘤生长。在接种肿瘤后第23天,与PBS和SM102-LNP处理相比,ATRA-LNP处理小鼠的肿瘤重量分别下降到16.9%和30.9%。ATRA-LNP还显著延长了荷瘤小鼠的生存时间。相比之下,SM102-LNP在抑制肿瘤生长方面表现出有限的疗效,与PBS组相比,未能延长动物生存时间。这些数据表明,ATRA-LNP增强了抗肿瘤免疫反应,并有效抑制了原位结肠肿瘤的生长。
研究结论
综上,研究人员开发了一款新型mRNA癌症疫苗,可以通过肌肉注射激活肠道黏膜表面的抗肿瘤免疫反应。ATRA纳入LNP不仅提高了其mRNA递送效率和脾脏的全身T细胞反应,而且还使激活的T细胞具有肠道趋向性,这显著增加了细胞毒性T细胞对原位结直肠肿瘤的浸润,从而增强了治疗效果。ATAR-LNP能抑制肿瘤生长和延长动物生存期。本研究为提高mRNA癌症疫苗对结直肠癌的治疗效果提供了一种有前途的方法。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com