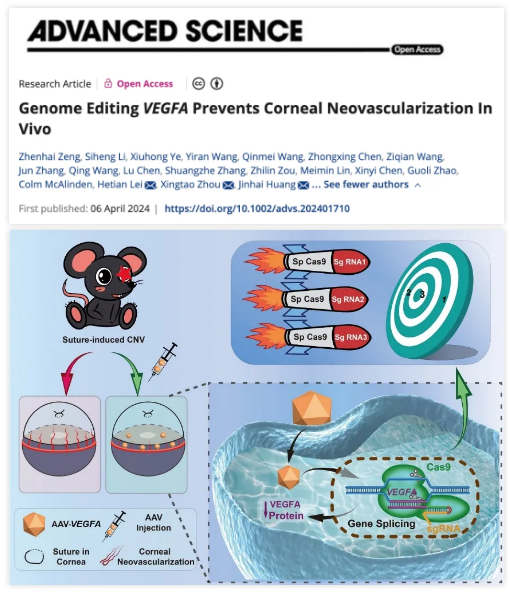
黄锦海/周行涛团队使用AAV介导的CRISPR基因编辑治疗角膜新生血管
角膜新生血管(Corneal Neovascularization)是一种重要致盲性眼部病变,全世界每年发病人数高达140万。角膜是视觉系统的重要屈光结构,角膜的无血管性对于保持角膜透明非常重要。正常情况下,角膜是免疫豁免器官,没有血管和淋巴管。然而,在感染、过敏、创伤、免疫排斥、缺血、缺氧和化学损伤等病理因素的作用下,角膜缘血管网形成新的毛细血管。这些新生血管侵入角膜并导致角膜基质浑浊、角膜表面不规则、角膜瘢痕和水肿、脂质沉积、光阻塞和视力丧失。
正常健康角膜的抗血管生成因子和促血管生成因子保持稳定平衡。一旦促血管生成的因子强于抗血管生成因子,角膜就会产生病理性新生血管。血管内皮生长因子A(VEGFA)是重要的血管生成因子,VEGFA的表达上调是角膜新生血管重要的原因。因此,VEGFA是角膜新生血管的治疗靶点。
然而,传统的抗VEGFA药物(例如小分子抑制剂、抗VEGFA抗体)的效果有限,不稳定,作用时间短,并可能引起不良反应。因此,角膜新生血管的治疗仍然是一个重大挑战。
近日,复旦大学附属眼耳鼻喉科医院黄锦海/周行涛团队与暨南大学附属深圳眼科医院雷和田教授团队、温州医科大学附属眼视光医院王勤美教授团队合作,在 Advanced Science 期刊发表了题为:Genome Editing VEGFA Prevents Corneal Neovascularization In Vivo(体内基因组编辑VEGFA阻止角膜新生血管生成)的研究论文。
该研究首次利用腺相关病毒(AAV)介导的CRISPR-Cas9基因编辑VEGFA在体内治疗角膜新生血,为利用CRISPR基因编辑策略治疗此类眼部疾病奠定了基础。
CRISPR-Cas9基因编辑技术为治疗人类疾病提供了新机会,美国FDA以批准了一款CRISPR-Cas9基因编辑疗法用于治疗β-地中海贫血和镰状细胞病。
在这项研究中,研究团队探索了在小鼠中使用CRISPR-Cas9基因编辑技术来抑制VEGFA的表达,从而抑制小鼠角膜新生血管的形成。
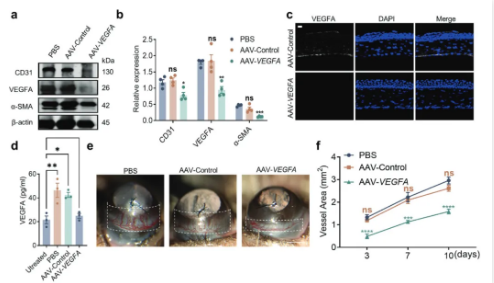
该研究显示,使用CRISPR-Cas9基因编辑系统靶向敲除VEGFA,可以在体外抑制人脐静脉内皮细胞(HUVEC)的增殖、迁移和血管形成。更重要的是,结膜下注射双AAV病毒载体递送的SpCas9/sgRNA-VEGFA系统,可以阻断角膜缝线诱导的VEGFA、CD31和α-平滑肌肌动蛋白的表达,以及小鼠角膜新生血管的形成。这项研究首次为通过基因编辑方法治疗角膜新生血管奠定了坚实基础。
该研究进一步表明,通过CRISPR-Cas9基因编辑来抑制眼组织中的VEGFA表达,不会影响视网膜功能,且并未影响身体的各个器官,这些结果证实了结膜下注射靶向VEGFA的双AAV病毒载体递送的CRISPR-Cas9系统后没有可检测到的毒性作用。
总的来说,该研究使用CRISPR-Cas9基因编辑系统敲除VEGFA基因来治疗小鼠缝线诱导的角膜新生血管。据悉,这是一项利用AAV介导的CRISPR-Cas9基因编辑系统在体内治疗角膜新生血管的研究,为利用CRISPR基因编辑策略治疗此类眼部疾病奠定了基础。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com