陈玲玲团队利用AAV递送环形RNA适配体,治疗阿尔茨海默病
阿尔茨海默病(AD)是一种年龄相关的神经退行性疾病,表现为进行性记忆衰退和认知功能障碍,其特征是β淀粉样蛋白(Aβ)斑块沉积和神经炎症,神经炎症在阿尔茨海默病发病机制中发挥着核心作用,因为它加剧了Aβ和Tau病理。
双链RNA(dsRNA)激活的蛋白激酶R(PKR)以其活化的磷酸化形式(p-PKR)参与关键的炎症通路。耗竭PKR在挽救阿尔茨海默病小鼠的神经突触和学习缺陷方面显示出潜力,使其成为潜在的治疗靶点。然而,目前的小分子PKR抑制剂往往会导致器官毒性等副作用,阻碍了其临床应用。
环形RNA(circRNA)是一类单链、共价,具有闭环结构RNA分子。近十年来研究发现了环形RNA普遍表达,并具有特定的生成加工、降解代谢及功能发挥的途径与规。相较于线性RNA,环形RNA具有高稳定性、特殊折叠和低免疫原性,使之具备改造为新型RNA适配体、蛋白质翻译载体等潜在生物医学应用前景。
值得注意的是,具有16-26bp不完美RNA双链结构的环状RNA(ds-cRNA)表现出强大的PKR抑制作用,这表明它有可能解决阿尔茨海默病中PKR过度激活的问题。
近日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组在预印本平台 bioRxiv 上发表了题为:Circular RNA aptamers ameliorate AD-relevant phenotypes by targeting PKR 的研究论文。
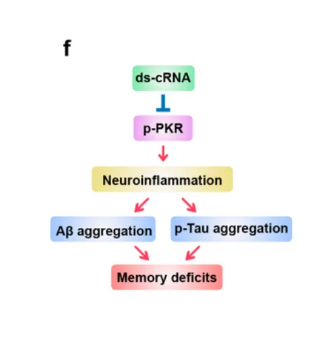
该研究表明,腺相关病毒(AAV)递送的环形RNA适配体,能够安全且有效抑制过度激活的蛋白激酶R(PKR),进而减少神经炎症和β-淀粉样蛋白(Aβ)斑块,实现对阿尔茨海默病小鼠的神经保护、增强其空间学习和记忆能力。这些发现表明,环形RNA适配体作为PKR抑制剂在阿尔茨海默病治疗中具有治疗潜力。
此前,陈玲玲团队通过优化RNA自剪接成环的新方法,实现了大规模合成低免疫原性且具有特殊双链结构环形RNA适配体(ds-cRNA),并在单分子水平阐明了ds-cRNA与蛋白激酶R(PKR)的作用机制,PKR与ds-cRNA的结合呈现为长时程、低解离的稳定结合模式,表明ds-cRNA提供了更适合PKR结合并限制其解离的空间构象。
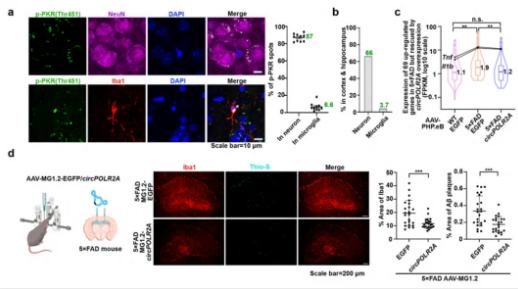
该研究在阿尔茨海默病小鼠模型中发现,随着阿尔茨海默病的发展,大脑海马体中出现了明显的神经炎症,伴随着双链RNA(dsRNA)激活的蛋白激酶R(PKR)和PKR相关dsRNA通路的逐步激活。
该研究进一步证实,在阿尔茨海默病小鼠模型中,使用腺相关病毒(AAV)将具有特殊双链结构的环形RNA适配体(ds-cRNA)递送到神经元和小胶质细胞,能够有效抑制过度激活的蛋白激酶R(PKR),在几乎没有毒性作用的情况下,减少神经炎症和β-淀粉样蛋白(Aβ)斑块,从而实现对阿尔茨海默病小鼠的神经保护,增强其空间学习和记忆能力。这些发现表明,ds-cRNA适配体作为PKR抑制剂在阿尔茨海默病治疗中具有治疗潜力。
ds-cRNA通过靶向神经元和小胶质细胞来拯救阿尔茨海默病表型
总的来说,该研究提出了腺相关病毒(AAV)递送ds-cRNA作为一种阿尔茨海默病的新兴治疗策略,通过靶向过度激活的PKR,抑制神经炎症和疾病进展进展。此外,考虑到AAV衣壳的免疫原性可能带来的长期治疗挑战,未来可以探索开发大脑特异性脂质纳米颗粒用于递送低免疫原性的ds-cRNA。
相关阅读
2024年4月23日,陈玲玲研究组在 Nature Biotechnology 期刊发表了题为:Therapeutic application of circular RNA aptamers in a mouse model of psoriasis 的研究论文。该研究通过优化RNA自剪接成环的新方法,可大规模合成低免疫原性的环形RNA适配体,并实现了环形RNA适配体在蛋白激酶R(PKR)异常激活相关的炎性疾病小鼠模型银屑病(psoriasis)的干预治疗。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com