美国国家癌症研究所(NCI)资助的一项新研究表明:罕见癌症“胃肠道间质瘤(GISTs)”的病因可能已被找到。不过,罪魁祸首并非有害的基因突变(这是癌症的典型特征),而是与突变无关的基因变化,即所谓的表观遗传变化。

多年来,癌症研究人员一直在研究表观遗传学。但是表观遗传领域仍然存在许多问题,其中之一就是:将表观遗传异常与特定疾病联系起来的潜在机制是什么?而由哈佛医学院麻省总院布拉德利·伯恩斯坦(Bradley Bernstein)博士领导的这项研究,是为数不多的将一种非常特殊的表观遗传变化确定为癌症病因的研究之一。
尽管绝大多数胃肠道间质瘤(GISTs)是由两种致癌基因(KIT和PDGFRA)突变引起的,但有将近10%的GIST肿瘤缺乏这些突变。而这些缺乏KIT和PDGFRA突变(也称为野生型GIST)的肿瘤大多具有遗传或表观遗传改变,导致一种名为SDH的蛋白质的丢失。
几年前,NCI的研究人员发现,缺乏SDH的GIST表现为广泛的表观遗传变化,但尚不清楚这些变化是否会导致肿瘤生长,以及如何导致肿瘤生长。
三维DNA景观
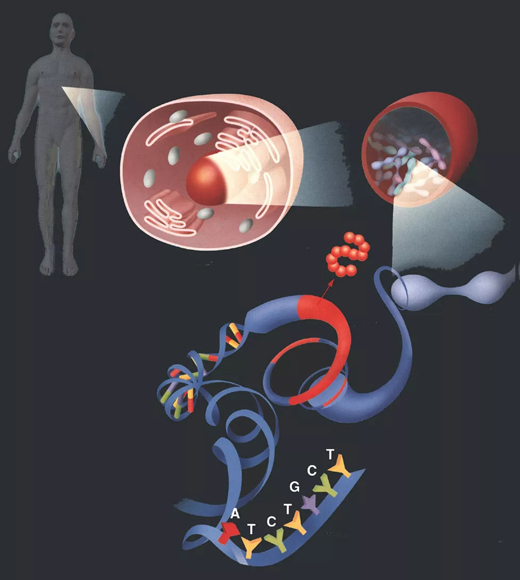
你可能不敢相信,每个人类细胞的细胞核有大约6英尺(约合1.8米)的DNA。为了实现,DNA被缠绕、编织、折叠成紧凑的结构,就像一堆纠缠在一起的纱线。但DNA并不是随意散布在细胞核周围的,而是被精心安排成一个精准的三维“景观”,DNA的每一部分都被放置在其中一个特定的位置。
这种精准的分布有助于控制哪些基因何时被激活。例如,DNA可以被折叠成环状,将某些基因与附近的“开启开关”分离开来。“开启开关”是DNA的一部分,它会使基因超速运转,即使它们产生更多的蛋白质。
伯恩斯坦博士解释道,表观遗传改变可以改变DNA的折叠方式,从而影响哪些基因被打开和关闭。这些改变在一定程度上是导致血细胞与神经细胞不同的原因,尽管它们拥有完全相同的一组基因。
在这项新的研究中,研究者们证实了表观遗传改变确实会导致SDH缺陷GIST的生长。
具体而言,他们发现,在缺乏SDH的GIST肿瘤中,被称为DNA甲基化的表观遗传变化取代了数百个DNA“锚”。伯恩斯坦博士解释说,锚在相邻的DNA环之间创造了物理边界,就像两个鞋带环之间的结一样。
一些被取代的锚点位于包含癌基因FGF3、FGF4和KIT的环路附近。而没有了锚点,致癌基因就能够与邻近回路的开启开关相互作用。
“在正常情况下,锚点保护致癌基因不受另一个回路的开启。但DNA甲基化破坏了锚点,导致环融合成一个。”伯恩斯坦博士说。
结果所有这三个基因都被激活,并产生了高水平的蛋白质。相比之下,KIT-或pdgfr突变GIST患者肿瘤中的FGF3和FGF4蛋白水平较低或未检测到。
“这些发现表明,即使没有突变,致癌基因仍然可以被有效激活。”伯恩斯坦博士说。
治疗的新机会?
那么,靶向KIT和FGF的药物是否可以阻止SDH-缺陷GIST的生长?为此,研究者们用来自SDH-缺陷GIST的患者的肿瘤样本建立了一个小鼠模型进行实验。
实验结果显示:用舒尼替尼(一种阻断KIT和其他蛋白质的药物)治疗小鼠对肿瘤生长的影响很小。但用Infigratinib治疗,一种阻止FGFR(与FGF相互作用的蛋白质)的实验药物,可以显著减缓肿瘤的生长。
研究人员发现,联合使用舒尼替尼和伊夫替尼治疗小鼠甚至更有效,甚至在停止治疗后,也比单独使用这两种药物更能在更大程度上和更长的时间内抑制肿瘤生长。
伯恩斯坦博士团队目前正与NCI的临床治疗评估项目合作,计划启动一项针对SDH缺陷GIST患者的Infigratinib临床试验。他们希望进一步验证这种新的联合疗法。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com


