豪森药业前列腺癌药物恩扎卢胺软胶囊申报上市
中国国家药监局药品审评中心(CDE)网站公示显示,豪森药业按照注册分类4类提交了恩扎卢胺软胶囊仿制药的上市申请,并于6月2日获受理。恩扎卢胺原研(enzalutamide)由安斯泰来(Astellas)和辉瑞(Pfizer)开发,是首款获得美国FDA批准可以治疗三种不同形态晚期前列腺癌的口服疗法,2019年销售额超40亿美元。目前中国境内仅有原研药物安可坦获批,豪森药业是一个提交恩扎卢胺仿制药上市申请的企业。
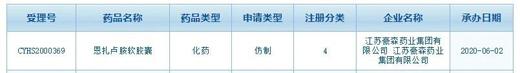
图片来源:CDE截图
前列腺癌是世界范围内男性第二大常见恶性肿瘤,转移性去势抵抗性前列腺癌预后不良,5年生存率约为29%,这些患者急需新的治疗选择。
恩扎卢胺是安斯泰来和辉瑞共同开发的一种雄激素受体信号传导抑制剂,它不但能够阻断雄激素与受体的结合,还能够抑制受体向细胞核内转移,以及雄激素受体与DNA的结合。因此它不仅仅是雄激素受体的拮抗剂,对雄激素信号通路也有抑制作用。
原研安可坦(英文商品名:Xtandi)于2012年首次在美国获批上市,目前已被获批治疗转移性去势抵抗性前列腺癌(mCRPC)、非转移性去势抵抗性前列腺癌(CRPC)、转移性去势敏感性前列腺癌。值得一提的是,这也是首款获得FDA批准,治疗三种不同形态晚期前列腺癌的口服疗法。
在中国,安可坦于2019年11月获得中国国家药品监督管理局(NMPA)批准上市,用于雄激素剥夺治疗(ADT)失败后无症状或有轻微症状且未接受化疗的转移性去势抵抗性前列腺癌成年患者的治疗。研究显示,接受安可坦治疗的患者,其前列腺特异性抗原(PSA)的进展风险显著降低,安可坦组的PSA进展中位时间为8.31个月,安慰剂组为2.86个月。与安慰剂组相比,接受安可坦治疗的患者的总生存期显著提高,死亡风险降低了67%。
根据CDE网站信息,豪森药业是一个提交恩扎卢胺软胶囊仿制药的上市申请的企业。此外,科伦药业、正大天晴、江西青峰药业、山西振东制药等多家企业也提交了恩扎卢胺的临床试验申请。
参考资料
[1]中国国家药监局药品审评中心. Retrieved Jun 02,2020, from http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=3
[2] XTANDI® (enzalutamide) Approved by U.S. FDA for the Treatment of Metastatic Castration-Sensitive Prostate Cancer. Retrieved December 16, 2019, from https://www.businesswire.com/news/home/20191216005826/en/XTANDI%C2%AE-enzalutamide-Approved-U.S.-FDA-Treatment-Metastatic
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com
